Иммунотерапия на основе естественных клеток-киллеров (НК-клетки) уничтожает и стимулирует дифференцировку химиорезистентных стволовых клеток рака
Рак разной степени злокачественности имеет высокий риск рецидива и прогрессирования что, по-видимому, в значительной степени связано с наличием онкогенных популяций стволовых клеток, устойчивых к традиционным методам лечения.
Здесь мы оценили терапевтический потенциал адоптивной иммунотерапии на основе клеток Natural Killer (NK) против химиорезистентных стволовых клеток с использованием NK-клеток здоровых доноров и пациентов с онкологией.
Выяснилось, что NK-клетки от пациентов с NMIBC и другими видами раков демонстрируют низкую плотность NK-рецепторов цитотоксичности, молекул адгезии и более незрелый фенотип, теряя свою способность убивать и стимулировать дифференцировку CSC (РСК).
Ингибирование NK-клеток опосредуется ингибирующими иммуноглобулин-подобными рецепторами клеток-киллеров или NKG2A/CD94, которые распознают классические или неклассические молекулы HLA класса I, соответственно, которые часто теряются или редуцированы в злокачественных клетках
Недавние отчеты разных групп исследователей продемонстрировали, что раковая опухоль содержит различные подмножества клеток, отражающие молекулярные особенности стволовых клеток, наделенных повышенной химиорезистентностью и способностью инициировать опухоль .
В дополнение к неэффективности традиционной химиотерапии в отношении стволовых клеток рака , исследования различных групп , специализирующихся на изучении проблем лечения онкозаболеваний, также показали, что кратковременное воздействие цисплатина индуцирует переход фенотипического состояния клеток в адаптивный стволоподобный фенотип, что свидетельствует о пластичности опухоли. И, таким образом, происходит спонтанное переключение между состояниями клеток при воздействии стрессовых состояний, таких как химиотерапия . Эти данные подкрепляют положение о движущей роли этих клеток в частых рецидивах РМЖ и др.видов рака, а также в качестве топлива для прогрессирования инвазивных форм .
Помимо повышенной химиорезистентности, РСК характеризуются способностью к самообновлению и дифференцировке. В исследованиях проверили, могут ли NK-клетки индуцировать CSC в сторону более дифференцированного фенотипа, делающего их восприимчивыми к химиотерапии.
Затем был проанализирован фенотипический статус и функциональность NK-клеток, собранных из периферической крови пациентов с раками различной степени злокачественности с высоким риском рецидива.
NK-клетки больных РМЖ менее чувствительны к активации цитокинов и проявляют сниженную литическую активность, особенно в отношении ОСК, из-за низкой экспрессии NCR и CD62L, имеющих решающее значение для распознавания и уничтожения клеток-мишеней, а также из-за присутствия незрелых CD57 - NK клетки. Помимо модифицированного фенотипа NK, повышенный уровень иммуносупрессивных цитокинов (TGF-β, IL-10 и IL-4) и сниженная экспрессия IFN-γ/TNF-α препятствовали эффективному противоопухолевому иммунному ответу и отменяли их индуцирующие дифференцировку воздействие на РСК [ 24 , 25 ] .Наконец, факторы, высвобождаемые NK-клетками больных РМЖ, были неэффективны в управлении дифференцировкой РСК, что может способствовать увеличению пула РСК и последующему прогрессированию опухоли.
Заметные уровни растворимой формы цепи А, родственной МНС класса I, идентифицированной как лиганд NKG2D человека, были обнаружены в сыворотке пациентов с диссеминированным плоскоклеточным раком головы и шеи и гепатоцеллюлярной карциномой человека и нейробластома .
Эти результаты подчеркивают роль микроокружения опухоли в нарушении иммунного ответа хозяина и литической функции NK и могут объяснить низкую эффективность адоптивного переноса аутологичных NK-клеток, часто наблюдаемую у онкологических больных с меланомой, лимфомой и раком молочной железы из-за дисфункции NK-клеток .
NK-клетки от онкопациентов продемонстрировали пониженную чувствительность к стимуляции цитокинами, о чем свидетельствует общий более низкий специфический лизис, со значительно сниженной цитотоксичностью против сфер ( P <0,01), в отличие от здоровых NK-клеток, которые демонстрировали равную способность убивать стволовые и родительские клетки (таблица 1 ). Фенотипический анализ показал снижение экспрессии NKp30, NKp44 и корецептора NKp80 в NK-клетках пациентов по сравнению с HD. Экспрессия молекулы адгезии CD62L и маркера терминальной дифференцировки CD57 была значительно снижена в NK-клетках больных РМЖ. Кроме того, NK-клетки пациентов продемонстрировали повышающую регуляцию иммуносупрессивных противовоспалительных цитокинов TGF-β, IL-4 и IL-10 и понижающую регуляцию провоспалительных цитокинов TNF-α и IFN-γ, что согласуется с нарушение активности NK-клеток (таблица 1 ).
| Здоровые доноры | Больные раком (мочевой пузырь) |
51 Анализ высвобождения Cr | ||
ХТ-1376 | 80,12 ± 4,14 % | 38,67 ± 8,88 %*** |
Сферы HT-1376 | 75,44 ± 6,53 % | 11,74 ± 3,12 %*** |
УМ-UC3 | 73,69 ± 5,40 % | 41,38 ± 10,71 %** |
Сферы UM-UC3 | 67,52 ± 7,61 % | 18,19 ± 4,17 %*** |
НКР | ||
НКп30 | 54,68 ± 4,98 % | 33,55 ± 5,09 %* |
НКп44 | 26,35 ± 9,18 % | 0,52 ± 0,20 %*** |
НКп46 | 42,93 ± 3,70 % | 49,09 ± 6,09 % |
НКп80 | 98,34 ± 0,32 % | 91,36 ± 2,20 %** |
CD62L | 33,40 ± 1,44 % | 24,30 ± 2,57 %* |
CD57 | 31,08 ± 2,54 % | 20,86 ± 2,14 %** |
Цитокины | ||
ФНО- α | 0,36 ± 0,13 % | 0,23 ± 0,08 % |
ИФН- γ | 0,23 ± 0,06 % | 0,08 ± 0,03 % |
ТФР-β | 0,14 ± 0,02 % | 0,32 ± 0,15 % |
Ил-4 | 0,007 ± 0,003 % | 0,42 ± 0,24 % |
Ил-10 | 0,81 ± 0,19 % | 3,36 ± 1,62 % |
- 51 Cr хром-51,природные цитотоксические рецепторы NCR
- * Р < 0,05;**Р < 0,01;***P <0,001 здоровыхдоноров (n = 8) посравнениюсбольнымиракоммочевогопузыря (n = 10)
Более того, воздействие на ОСК супернатантов NK, полученных из клеток больных РМЖ, не снижало экспрессию маркеров, связанных со стволовостью, в сферах. Скорее, наблюдалась тенденция к активизации большинства проанализированных генов, что позволяет предположить, что NK-клетки высвобождают факторы, которые поддерживают или усиливают признаки стволовости опухолевых клеток
НК-клетки здоровых доноров
Полученные результаты
Цитокин-активированные NK-клетки от здоровых доноров и от пациентов с разной степенью злокачественности процесса были фенотипически охарактеризованы и проанализированы in vitro на предмет стволовых и объемно-дифференцированных клеток рака.
Стволоподобные клетки были выделены из нескольких клеточных линий рака с использованием анализа образования сфер. Терапевтическую эффективность оценивали in vivo .
В то время, как NK-клетки от здоровых доноров при активации IL-2 и IL-15 убивают без разбора как стволовые, так и дифференцированные опухолевые клетки за счет распознавания стрессового лиганда.
Кроме того, NK-клетки сдвигают CSC в сторону более дифференцированного фенотипа, делая их более восприимчивыми к цисплатину, что подчеркивает преимущества возможной комбинированной терапии.
Введение же активированных NK-клеток от здоровых доноров обеспечивает эффективную инфильтрацию опухоли и последующую сильную тумороцидную (противоопухолевую) активность в отношении рака даже с высокой селективной цитолитической активностью в отношении Раковых Стволовых Клеток.
Результаты убедительно свидетельствуют о том, что иммунотерапевтическая стратегия с использованием аллогенных активированных NK-клеток от здоровых доноров эффективна и должна использоваться в качестве дополнительной терапевтической стратегии у пациентов с высоким риском для предотвращения рецидива и прогрессирования опухоли.
Таким образом, разработка терапевтических стратегий, направленных на борьбу со стволовым раком (Стволовыми Раковыми Клетками), имеет важное значение для предотвращения рецидива и прогрессирования опухоли и представляет собой важную линию в лечении .
Естественные клетки-киллеры (NK) являются важными игроками врожденной иммунной системы с сильной цитолитической активностью против инфицированных вирусом или неопластических клеток без предварительной иммунной сенсибилизации, что делает их привлекательными терапевтическими эффекторами против рака .
Эти клетки секретируют воспалительные цитокины и хемокины, которые впоследствии формируют врожденный и адаптивный иммунный ответ, способствуя дифференцировке, активации и рекрутированию дополнительных иммунных клеток в очаг опухоли .
Биологическая активность NK-клеток регулируется динамическим балансом между активирующими и подавляющими сигналами, обеспечивая взаимодействие с клетками-мишенями, и растворимыми факторами, высвобождаемыми в микроокружении опухоли, что в совокупности и определяет их эффективность
В отличие от традиционной химиотерапии, NK-клетки распознают и убивают недифференцированные стволовые клетки в силу своей способности нацеливаться на неделящиеся клетки.
NK-клетки экспрессируют различные активирующие рецепторы, в том числе член D NK-группы 2 (NKG2D), вспомогательную молекулу-1 DNAX (DNAM-1) и рецепторы естественной цитотоксичности (NCR: NKp30, NKp44 и NKp46), которые обеспечивают активирующие сигналы при связывании со стресс-индуцированными лигандами, которые экспрессируются в опухолевых, но не в нормальных клетках.
Эти результаты, наряду с значимостью Опухолевых Стволовых Клеток в прогрессировании РМЖ и прочих видах рака и неэффективностью современных методов лечения, побудили провести оценку терапевтического потенциала адоптивной иммунотерапии на основе NK-клеток в эрадикации компетентных ОСК и ее влияние на прогрессирование опухоли.
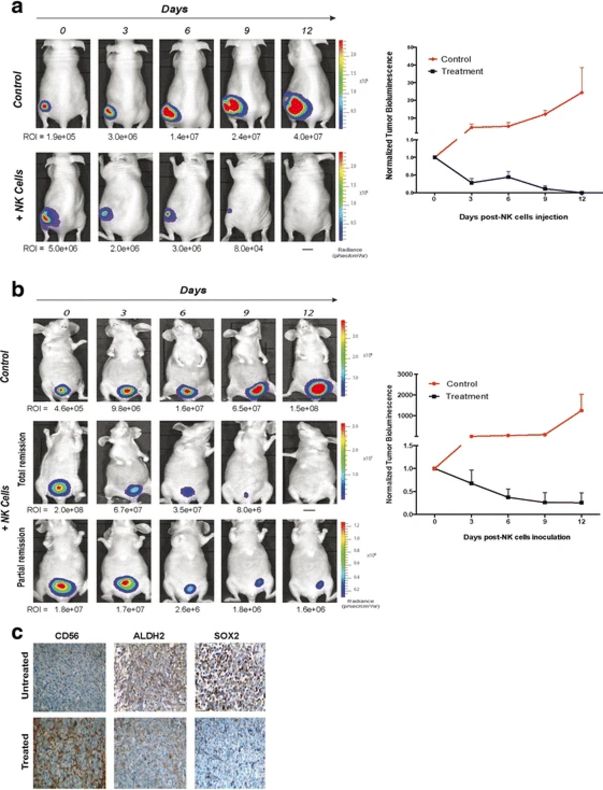
Сначала оценивалась противоопухолевая активность NK-клеток у мышей с локализованными подкожными опухолями. Лечение начинали через 6 дней после инокуляции клеток и проводили два раза в неделю путем внутриопухолевой инъекции 5×10 6 активированных NK-клеток. Наблюдалось немедленное и прогрессирующее уменьшение размера опухоли, которое полностью прекращалось после четвертого введения . В это время лечение заканчивали и за животными наблюдали до 2 недель, рецидива опухоли не наблюдали.
После этого был протестировали тот же подход, но в органоспецифической микросреде с использованием ортотопической модели . NK-клетки вводили через 4 недели после имплантации опухолевых клеток. Лечение привело к прогрессивному уменьшению опухолевой массы на 80 % после четвертой прививки с полной ремиссией у одного из пяти обработанных животных.
Аллогенные активированные NK-клетки от здоровых доноров эффективны в уничтожении раковых стволовых клеток в моделях рака мочевого пузыря на мышах. a Серийные биолюминесцентные изображения репрезентативной мыши с подкожной опухолью после внутриопухолевой инъекции активированных NK-клеток. b Противоопухолевое действие активированных NK-клеток, введенных внутриопухолево мышам с ортотопическим раком мочевого пузыря. Всех животных обрабатывали два раза в неделю 5×10 6 NK-клеток в течение 2 недель и контролировали каждые 3 дня после лечения. Размер опухоли оценивали путем количественного определения биолюминесцентного сигнала (фотоны/сек/см 2/sr) в интересующей области вокруг опухоли. На графиках представлена прогрессияопухолиунелеченыхилеченыхживотных, нормализованнаяпобиолюминесцентномусигналувначалелечения (n = 5 нагруппу).c Иммуногистохимическое окрашивание на CD56, ALDH2 и SOX2 в серийных срезах ортотопической необработанной опухоли (верхний ряд) и остаточной обработанной опухоли после четвертого внутрипузырного введения активированных NK-клеток (нижний ряд). Оригинальное увеличение: ×400
Серьезной проблемой при лечении РМЖ является риск прогрессирования в мышечно-инвазивные формы или метастатическое заболевание, процесс, который, по-видимому, тесно связан с наличием ОСК, устойчивых к современным традиционным методам лечения. Были предоставлены доказательства того, что как стволовые, так и не стволовые клетки могут быть распознаны и эффективно уничтожены ex vivo-активированными аллогенными NK-клетками от HD (Здоровых Доноров), но не от пациентов с онкологией.
Важно отметить, что NK-клетки высвобождают критические факторы, которые регулируют переключение сфер в более дифференцированный статус, тем самым обращая их устойчивость к цисплатину и указывая на двойное влияние на истощение пула CSC путем прямого уничтожения и образования дифференцированных клеток, уязвимых для обычных методов лечения. Этот эффект индукции-дифференциации, уже описанный и называемый расщеплением энергии, был приписан анергизированным NK-клеткам, которые теряют цитотоксичность, но увеличивают секрецию цитокинов (IFN-γ, TNF-α), индукторов дифференцировки CSC
Исследования in vivo показали замечательную противоопухолевую активность здоровых активированных NK-клеток в моделях ксенотрансплантата BC. Внутриопухолевая доставка активированных NK-клеток приводит к полному исчезновению подкожных опухолей без признаков рецидива, что, вероятно, отражает способность NK-клеток убивать CSC и не-CSC. В ортотопической модели внутрипузырное введение NK-клеток приводило к массивному уменьшению опухолевой массы, четко демонстрируя присущую NK-клеткам способность к уничтожению в микроокружении опухоли.
Значительно сниженная экспрессия маркеров стволовости в остаточных опухолях подтверждает способность NK-клеток нацеливаться на РСК в дополнение к элиминации дифференцированных опухолевых клеток.
Можно утверждать, что эта огромная противоопухолевая эффективность в значительной степени связана с обширной инфильтрацией опухоли NK-клетками.
Это наблюдалось на животных моделях и в клинических исследованиях и считается критическим фактором для эффективной адоптивной терапии NK-клетками при системном введении . Врожденная способность NK-клеток нацеливаться на популяцию как стволовых, так и не стволовых клеток имеет первостепенное значение для достижения значимой ремиссии заболевания и улучшения выживаемости, поскольку нестволовые клетки могут переключаться на стволоподобный фенотип, способный поддерживать рост опухоли. .
Так же было продемонстрировано, что внутриопухолевая терапия аллогенными NK-клетками, активированными ex vivo, обеспечивает быстрый и заметный противоопухолевый ответ против РМЖ, воздействуя как на популяции стволовых, так и не стволовых клеток. Важно отметить, что способность NK-клеток управлять дифференцировкой CSC, рассматриваемых как основные предшественники мышечно-инвазивных форм, вероятно, предотвращает или отсрочивает рецидив и/или прогрессирование заболевания.
Эти результаты свидетельствуют о высоком терапевтическом потенциале адоптивной иммунотерапии на основе NK-клеток в эрадикации РСК (при раке мочевого пузыря, РМЖ, кишечника, легких, яичников , предстательной железы, глиобластомы и пр. )подходе, который следует использовать как часть комбинаторной терапевтической стратегии при онкозаболеваниях.
1. Робертсон М.Дж., Ритц Дж. Биология и клиническое значение естественных клеток-киллеров человека. Кровь. 1990; 76: 2421–38.
https://www.sciencedirect.com/science/article/pii/S0006497120808568?via%3Dihub
2. Салагианни М., Бахеванис К.Н., Папамихаил М., Перес С.А. Новое понимание роли NK-клеток в иммунотерапии рака. Онкоиммунология. 2012;1:205–7.
3. Юн С.Р., Ким Т.Д., Чой И. Понимание молекулярных механизмов терапии естественными клетками-киллерами. Эксп Мол Мед. 2015;47, e141.
https://pubmed.ncbi.nlm.nih.gov/25676064/
4.Пьетра Г., Манзини С., Витале М., Бальзамо М., Оньо Э., Бойтано М. и др. Естественные клетки-киллеры убивают клетки меланомы человека с характеристиками раковых стволовых клеток. Инт Иммунол. 2009; 21: 793–801.
https://academic.oup.com/intimm/article/21/7/793 /820040?login=false
5.Джинуши М., Такехара Т., Тацуми Т., Хирамацу Н., Сакамори Р., Ямагути С. и др. Нарушение функций естественных клеток-киллеров и дендритных клеток растворимой формой цепи А, родственной МНС класса I, при прогрессирующих гепатоцеллюлярных карциномах человека. J Гепатол. 2005;43:1013–20.
https://www.journal-of-hepatology.eu/article/S0168-8278(05)00422-8/fulltext
6. Клосс С., Хюнеке С., Пиехулек Д., Эссер Р., Кох Дж., Брем С. и соавт. IL-2-активированные гаплоидентичные NK-клетки восстанавливают NKG2D-опосредованную цитотоксичность NK-клеток у пациентов с нейробластомой путем удаления MICA из плазмы. Евр Дж Иммунол. 2010;40:3255–67.
https://onlinelibrary.wiley.com/doi/10.1002/eji.201040568
7. Краузе С.В., Гастпар Р., Андрисен Р., Гросс С., Ульрих Х., Тонигс Г. и др. Лечение пациентов с раком толстой кишки и легких с помощью ex vivo активированных белком теплового шока 70-пептидных аутологичных естественных клеток-киллеров: клиническое испытание фазы I. Клин Рак Рез. 2004; 10:3699–707.
8. Леви Э.М., Роберти М.П., МордохДж. Естественныеклетки-киллерыприракечеловека: отбиологическихфункцийдоклинических применений. Дж. Биомед Биотехнолог. 2011;2011:676198.