МЕХАНИЗМ ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ САЛИНОМИЦИНА
Показано, что салиномицин вызывает апоптоз в разных типах опухолевых клеток человека.
В том числе даже в тех, которые обладают высокой устойчивостью к действию противоопухолевых препаратов, преодолевая множественную лекарственную устойчивость опухолевых клеток, обусловленную разными механизмами.
Показана избирательность действия салиномицина в отношении опухолевых клеток, в том числе в гормонально-резистентных (линия РС3) клетках предстательной железы.
В свою очередь, в различных исследованиях показано, что даже в процессе селекции не удается получить резистентные к салиномицину опухолевые и стволовые опухолевые клетки.
Салиномицин - препарат, который эффективно атакует стволовые раковые клетки.
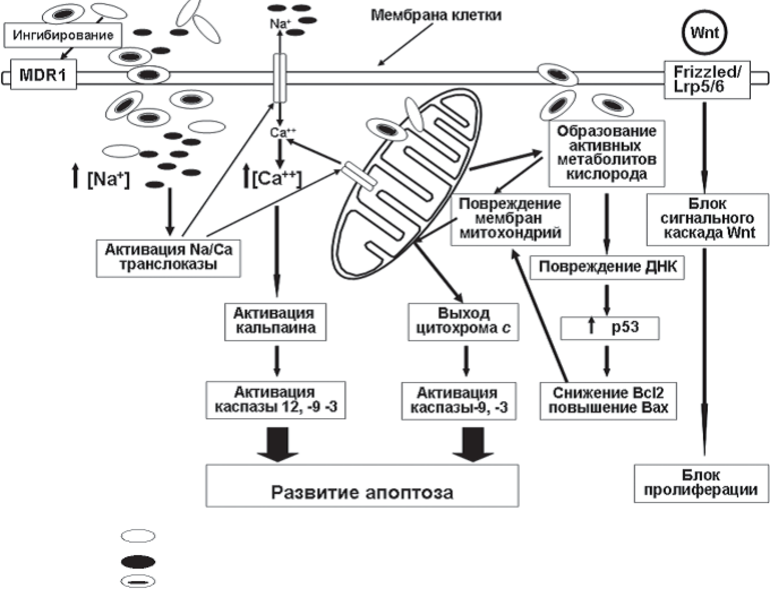
Важной составляющей действия салиномицина является и ионофорная активность, в результате которой в клетках-мишенях развиваются сложные изменения обменных процессов, повышается уровень внутриклеточного кальция, что приводит клетку к гибели. Так же в развитии повреждения клеток важную роль играет активация Na/Са-транслоказы. Повышение активности этого фермента вызывается ростом в цитоплазме концентрации ионов натрия, возникающим в результате его переноса салиномицином через клеточную и митохондриальную мембрану. Функционирование фермента происходит в «обратном» направлении, что приводит к повышению концентрации ионов кальция и искажению многих биохимических процессов в клетке, включая развитие апоптоза. Способность салиномицина вызывать повышение уровня внутриклеточного кальция связана с ингибированием сигнального каскада Wnt/LRP6 при воздействии препарата
.
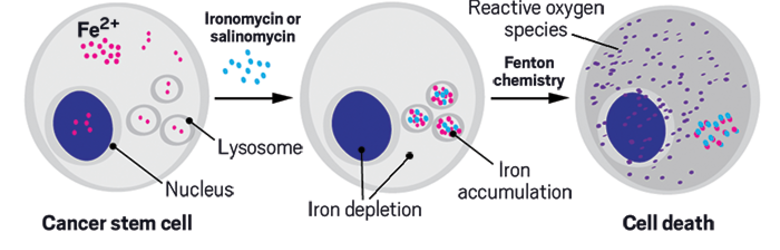
Салиномицин (синие точки) работают путем секвестрации железа, что приводит к гибели клеток.
Credit: Nature Chemistry
Под действием салиномицина происходит нарушение структуры мембран митохондрий и их функционирования, что сопровождается повышенным образованием активных метаболитов кислорода, повреждению ДНК и индукции апоптоза с участием белка р53, с последующим усилением повреждения митохондрий и развитию апоптоза.
В механизме повреждения клеток при действии салиномицина ведущую роль играло повышение концентрации активных метаболитов кислорода (АМК), которое регистрировалось уже через 15 мин.
Уже через 24 ч после применения салиномицина наблюдаются такие морфологические признаки апоптоза, как сморщивание клеток и ядер и конденсация хроматина(Хроматин находится внутри ядра клеток, представляет собой комплекс ДНК, РНК и белков. Конденсация хроматина - наиболее характерное проявление апоптоза, обусловленное расщеплением ядерной ДНК , что приводит к образованию большого количества фрагментов, в которых число пар оснований делится на 180-200. Эта картина отличается при некрозе клеток, где длина фрагментов ДНК варьирует).
Индуцированные салиномицином повреждения ДНК стимулируют развитие апоптоза опухолевых клеток.
Важным свойством салиномицина является его способность обеспечивать преодоление резистентности опухолевых клеток, обусловленной действием ABC-транспортеров.
Следует отметить, что АВС- транспортеры АBCB1, ABCG2 и ABCC2 обнаружены в апикальных мембранах клеток, формирующих эпителиальные барьеры, и в мембранах гепатоцитов, обращенных в просвет канальцев.
Эти же транспортеры присутствуют в клетках, формирующих гематоэнцефалический барьер, барьер в семенниках и фетоплацентарный барьер, что делает мозг, семенники и плод труднодоступными для действия многих фармакологических препаратов. Поэтому эти барьеры проницаемы для салиномицина. Так же салиномицин может изменять фармакокинетику некоторых вводимых per os лекарств.
Молекулярные механизмы противоопухолевой активности салиномицина: 1 – салиномицин; 2 – ионы натрия; 3 – комплекс салиномицина с ионами натрия (соль)
Помимо прямой противоопухолевой активности, салиномицин обладает способностью сенсибилизировать клетки, устойчивые к действию доксорубицина и этопозида.
При одновременном действии доксорубицина и салиномицина на клетки рака молочной железы и клетки саркомы матки через 48 ч обнаружена более интенсивная гибель клеток, чем при действии только доксорубицина.
Обнаружено повышение противоопухолевой активности паклитакселя и способности элиминировать ОСК при совместном действии с салиномицином. Салиномицин способен сенсибилизировать (повышает чувствительность) опухолевые клетки (рак молочной железы, линии клеток MCF7 и Hs578T) к действию облучения . Совместное воздействие облучения (4 Гр) и салиномицина (5 мкМ) сопровождалось развитием апоптоза и снижением выживаемости клеток
Таким образом, салиномицин усиливает действие факторов, вызывающих повреждение ДНК (антрациклиноваых антибиотиков и ионизирующего излучения), а кроме того, и действие таксанов (паклитакселя), что, безусловно, имеет важное клиническое значение.
Для снижения неспецифической токсичности создана специальная депонированная форма салиномицина на основе носителей-наноалмазов, которая обеспечивает его эффективное локальное действие благодаря созданию высоких концентраций только в зоне мишени.
Анализ приведенных данных позволяет полагать, что салиномицин обладает противоопухолевой активностью, в основе которой лежит новый для противоопухолевых препаратов механизм действия – ионофорная активность этого антибиотика. С использованием салиномицина могут быть разработаны новые подходы для лечения опухолей, особенно характеризующихся множественной лекарственной устойчивостью, а также более эффективные методы противоопухолевой терапии, основанные на элиминации ОСК.