1.Antitumor activity of ionophore antibiotic salinomycin: the target – cancer stem cells
Противоопухолевая активность ионофорного антибиотика салиномицина: мишень – опухолевые стволовые клетки
https://molmedjournal.ru/en/molecmed-2012-06-04
2.Therapeutic strategies targeting cancer stem cells.
Терапевтические стратегии, нацеленные на раковые стволовые клетки.
Cancer Biol Ther. 2013 Jan 28.
https://www.ncbi.nlm.nih.gov/pubmed/23358473
3.Влияние салиномицина на линию клеток рака яичников человека OV2008 связано с модулированием p38 MAPK.
Effects of salinomycin on human ovarian cancer cell line OV2008 are associated with modulating p38 MAPK. 2012 Jul 7.
https://www.ncbi.nlm.nih.gov/pubmed/22773373
4.Салиномицин избирательно нацеливается на клеточные субпопуляции CD133 + и уменьшает злокачественные признаки в линиях колоректального рака.
Ann Surg Oncol. 2011 Jun;18
Salinomycin selectively targets 'CD133+' cell subpopulations and decreases malignant traits in colorectal cancer lines.
https://www.ncbi.nlm.nih.gov/pubmed/21267784
5.Cytotoxic activity of the ionophore antibiotic salinomycin and its combination with anticancer preparations against human melanoma cells
Цитотоксическая активность ионофорного антибиотика салиномицина и его комбинации с противоопухолевыми препаратами в отношении клеток меланомы
https://molmedjournal.ru/en/molecmed-2013-03-09
6.NEW METHOD TAKES AIM AT AGGRESSIVE CANCER CELLS
НОВЫЙ МЕТОД НАЦЕЛЕН НА АГРЕССИВНЫЕ РАКОВЫЕ КЛЕТКИ
http://wi.mit.edu/news/archive/2009/new-method-takes-aim-aggressive-cancer-cells

In a comparison of a control to the chemical identified by the Weinberg/Lander team, called salinomycin, the tumor cells (stained dark purple in the slide below) were unaffected by the control, but salinomycin killed many tumor cells (stained pink).
Image: Piyush Gupta, Kai Tao, Charlotte Kuperwasser, Cell, August 21, 2009.
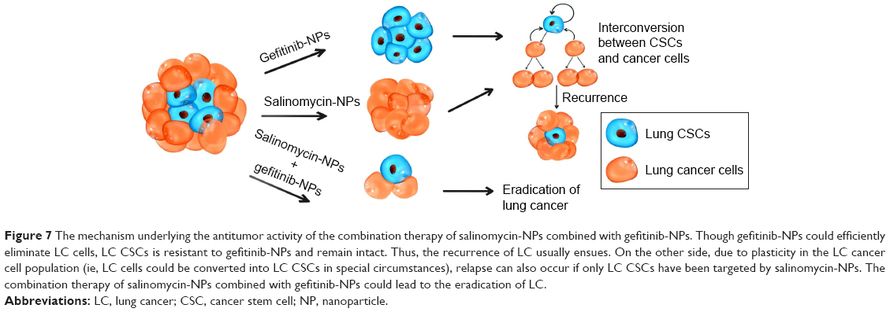
7.The combination therapy of salinomycin and gefitinib using poly(D,L-lactic-co-glycolic acid)-poly(ethylene glycol) nanoparticles for targeting both lung cancer stem cells and cancer cells
Комбинированная терапия салиномицином и гефитинибом с использованием наночастиц поли (D, L-молочная-со-гликолевая кислота) -поли (этиленгликоль) для воздействия как на стволовые клетки рака легких, так и на раковые клетки
Сокращения: LC, рак легких; CSC, раковая стволовая клетка; НП, наночастица.
Фигура 9: модель гибели клеток, вызванной гефитинибом и салиномицином в комбинации. Салиномицин (SAL) и гефитиниб (GEF) действовали вместе для увеличения продукции активных форм кислорода (ROS), потери потенциала митохондриальной мембраны (MMP) и потенциала лизосомальной мембраны (LMP). Продукция ROS, вызванная GEF и SAL, способствовала потере LMP и MMP. SAL и GEF взаимодействовали, вызывая LMP и цитоплазматическое высвобождение катепсина B и D. А затем цитоплазматический катепсин B и D способствовал потере ММР и каспазо-независимой гибели клеток. Кроме того, цитоплазматический катепсин B и D усиливали транслокацию цито-с (цитохрома с) в цитозоль и вызывали впоследствии апоптоз зависимой от каспазы-3 клетки. Кроме того, два препарата взаимодействовали, вызывая проницаемость митохондрий, что способствовало потере LMP.
9.Двойное нацеливание андрогенного рецептора и mTORC1 салиномицином при раке предстательной железы.
Dual targeting of androgen receptor and mTORC1 by salinomycin in prostate cancer.
https://www.ncbi.nlm.nih.gov/pubmed/27557496

Снижение экспрессии AR, фосфорилирования AR Ser-81, а также экспрессии CYP17A1 и HSD3β1 приводило к ингибированию активности AR. Салиномицин ингибировал ось PI3K → AKT → mTORC1 из-за 1) активации AMPK, которая, в свою очередь, индуцировала фосфорилирование хищника, а связывание 14-3-3 с фосфораптором ослабляло функцию киназы mTOR (14). Активированный AMPK также усиливал активность TSC2 / TSC1, опосредуя стимулирующее фосфорилирование TSC2 на Ser-1387; 2) ингибирование оси AKT → TSC2, поскольку ингибирующее фосфорилирование TSC2 по Ser-939 / Thr-1482, катализируемое AKT, было снижено. Повышенная активность TSC2 / TSC1 приводила к инактивации mTORC1. Опосредованное салиномицином нацеливание оси AKT → TSC2 смягчало влияние активации AKT, вызванное усилением активности PI3K, которое было результатом потери репрессии обратной связи.
10. Салиномицин проявляет активность против колоректального рака, воздействуя на комплекс β-катенин / Т-клеточный фактор
Salinomycin exerts anti‐colorectal cancer activity by targeting the β‐catenin/T‐cell factor complex
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6692576/
11.Combined using of paclitaxel and salinomycin active targeting nanostructured lipid carriers against non-small cell lung cancer and cancer stem cells
Комбинированное использование паклитаксела и салиномицина с активным нацеливанием на наноструктурированные липидные носители против немелкоклеточного рака легкого и раковых стволовых клеток
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6427498/
12.Салиномицин: противоопухолевая активность в доклинической модели колоректального рака
Salinomycin: Anti-tumor activity in a pre-clinical colorectal cancer model
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6375586/
мы продемонстрировали, что салиномицин обладает повышенной антипролиферативной активностью по сравнению с лечением 5-фторурацилом и оксалиплатином. Соответственно, салиномицин отдельно или в комбинации с FOLFOX проявляет более высокую противоопухолевую активность по сравнению с FOLFOX-терапией при колоректальном раке. Салиномицин вызывает апоптоз клеток колоректального рака человека, сопровождающийся накоплением дисфункциональных митохондрий и активных форм кислорода. Эти эффекты связаны с выраженной понижающей регуляцией супероксиддисмутазы-1 (SOD1) в ответ на лечение салиномицином.
13.Combination of salinomycin and gemcitabine eliminates pancreatic cancer cells.
Комбинация салиномицина и гемцитабина устраняет раковые клетки поджелудочной железы.
https://www.ncbi.nlm.nih.gov/pubmed/22030254
Gupta и его коллеги идентифицировали салиномицин на модели рака молочной железы, чтобы продемонстрировать селективную токсичность для эпителиальных CSC с гораздо большей эффективностью, чем у паклитаксела, распространенного химиотерапевтического агента, используемого при раке молочной железы, а позднее было найдено терапевтически перспективным при раке поджелудочной железы
мы изучили эффективность комбинированного лечения салиномицином и гемцитабином в клетках рака поджелудочной железы человека. Салиномицин ингибировал рост CSC, в то время как гемцитабин подавлял жизнеспособность не-CSC. Соответственно, исследования in vivo показали, что салиномицин в сочетании с гемцитабином может более эффективно устранять приживление рака поджелудочной железы человека, чем отдельные препараты. Эти данные указывают на то, что введение салиномицина, который нацелен на CSC, может представлять собой потенциальную терапевтическую стратегию для повышения эффективности гемцитабина для ликвидации рака поджелудочной железы.
14.Салиномицин подавляет сигналы PDGFRβ, MYC и Notch при медуллобластоме человека
Salinomycin Suppresses PDGFRβ, MYC, and Notch Signaling in Human Medulloblastoma
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4251667/
Наше исследование демонстрирует, что салиномицин проявляет цитотоксические эффекты в клетках МБ человека. Наши данные показывают, что лечение салиномицином эффективно ингибирует пролиферацию клеток MB, прогрессирование клеточного цикла и индукцию гибели клеток. Мы также показываем, что клетки MB изменили несколько сигнальных путей после лечения салиномицином. Негативная регуляция PDGFRβ и MYC и подавление сигнального пути Notch, вероятно, являются способствующими факторами цитотоксических эффектов салиномицина. Взятые вместе, это исследование предполагает, что салиномицин является потенциальным эффективным терапевтическим средством от МБ.
Мы демонстрируем, что салиномицин обладает выраженной цитотоксичностью в отношении клеток МБ человека. Этот вывод подтверждается дозозависимым увеличением гибели клеток (популяция суб-G0) и значительным снижением пролиферации клеток при лечении салиномицином.
.
.