1.https://www.spandidos-publications.com/10.3892/ijo.2017.4082
Salinomycin's potential to eliminate glioblastoma stem cells and treat glioblastoma multiforme (Review).
Салиномицин в уничтожении стволовых клеток глиобластомы и лечении мультиформной глиобластомы (обзор). сентябрь 2017
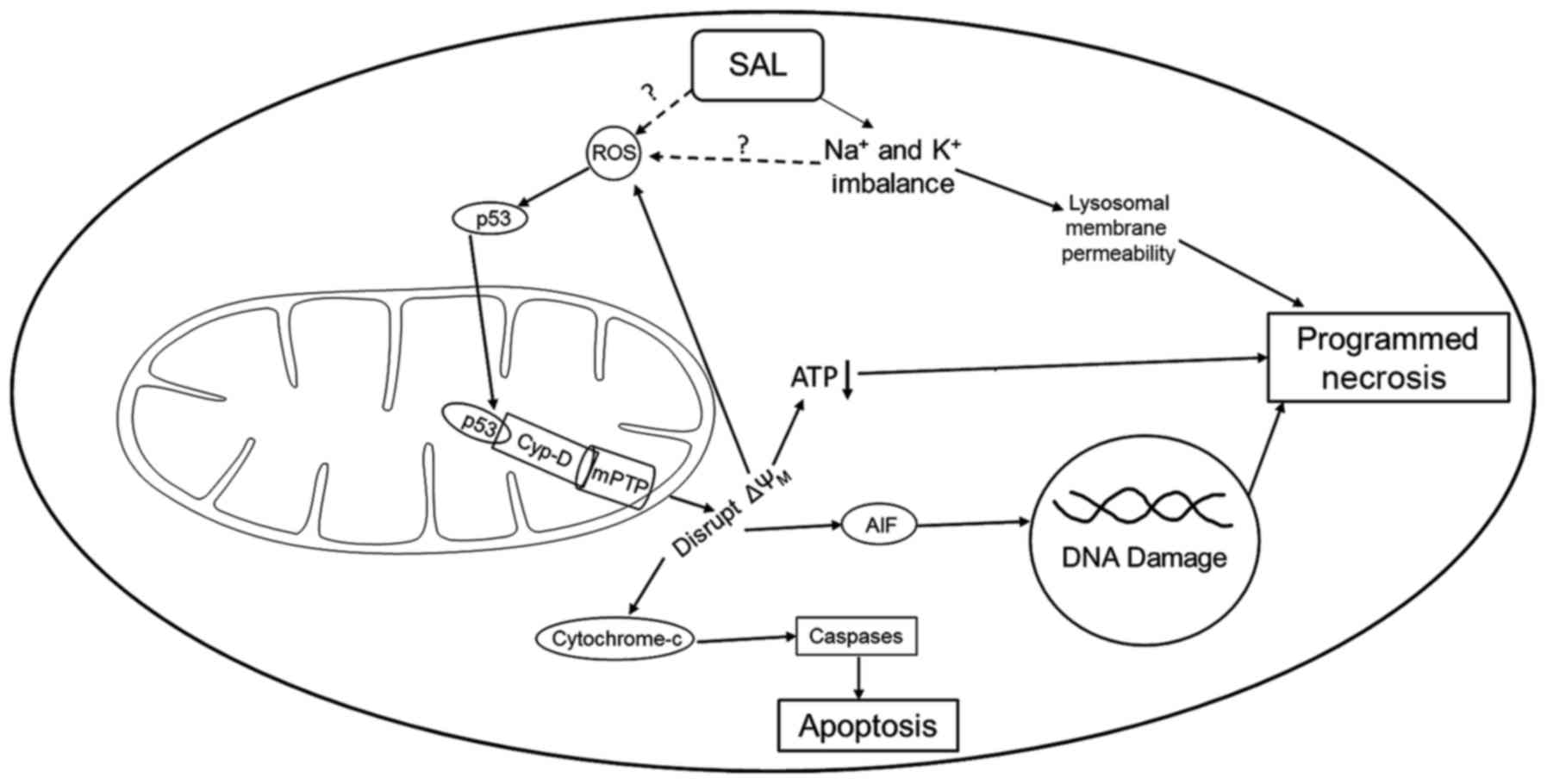
Краткое изложение механизма действия салиномицина на ГБМ(глиобластома):
Либо прямой, либо косвенный метод вызывает активацию АФК, что приводит к миграции р53 в митохондрии. В митохондриях р53 образует комплекс с Cyp-D, чтобы открыть переходную пору проницаемости митохондрий, нарушая потенциал мембраны митохондрий и приводя к высвобождению цитохрома с и AIF. Цитохром с активирует каспазы, вызывающие апоптоз, в то время как AIF повреждает ДНК, приводя к запрограммированному некрозу. Разрушение митохондриальной мембраны также снижает выработку АТФ, добавляя еще один сигнал к некрозу. В дополнение к положительной регуляции АФК, салиномицин вызывает дисбаланс Na + и K +, который влияет на проницаемость лизосомальной мембраны, а также приводит к запрограммированному некрозу опухолевых клеток.
Мультиформная глиобластома (ГБМ) - наиболее распространенной и самая смертельная форма первичной опухоли головного мозга. Хотя в настоящее время стандартное лечение включает в себя строгий режим хирургии, лучевой терапии и химиотерапии темозоломидом, его эффективность остается низкой. Медиана выживаемости для этого состояния составляет всего 14,6 месяца. Темозоломид является единственной одобренной FDA химиотерапией для первичного ГБМ
Исследования показали, что стволовые клетки глиобластомы (GSCs) не чувствительны к Темозоламиду. Эти исследования также обнаружили ряд генетических факторов, препятствующих эффективности темозоломида в отношении ГБМ
Препаратом для уничтожения GSC(глиобластомы) является салиномицин.
Наиболее убедительные исследования указывают на то, что некроз является преобладающим механизмом, вызванной салиномицином, в результате воздействия на ГБМ. Салиномицин приводит к трем наиболее распространенным причинам некроза: низкий уровень внутриклеточной АТФ, проницаемость лизосомных мембран и осмотический отек (путем повышения АФК и ухудшения мембранного потенциала митохондрий)
При использовании салиномицина в комбинации с химиотерапевтическими агентами темозоломид (TMZ), кармустин (BCNU) и ломустин (CCNU) в двухфазном подходе к лечению, только 21% лунок, обработанных TMZ / салиномицином, содержали какие-либо живые клетки, что определяет комбинированную терапию с TMZ и салиномицином для лечения и увеличения выживаемости пациентов.
В сочетании с вальпроатом, даже низкая концентрация салиномицина вызывала значительную гибель клеток глиобластомы.
Важно, что салиномицин, убивая GSC, не наносит вреда нормальным нервным клеткам.
Salinomycin encapsulated nanoparticles as a targeting vehicle for glioblastoma cells.
Инкапсулированные салиномицином наночастицы в качестве нацеливающего носителя для клеток глиобластомы. (октябрь 2015)
NF(наночастицы) + Sali(салиномицин) эффективно убивают клетки глиобластомы с улучшенной цитотоксичностью по сравнению со свободным Sali (салиномицином), что объясняется постепенным высвобождением лекарственного средства в течение 48-часового периода воздействия. Кроме того, и Sali, и NFs + Sali были способны индуцировать внутриклеточные АФК, определяющий фактор, заставляющий раковые клетки подвергаться апоптотической гибели. Наконец, исследования экспрессии генов показали, что NFs + Sali могут повышать экспрессию генов-супрессоров опухолей Rbl1 и Rbl2, а также каспазы 3, что может приводить к каспаззависимому апоптозу, и одновременно уменьшенный путь передачи сигналов Wnt.
Salinomycin-loaded lipid-polymer nanoparticles with anti-CD20 aptamers selectively suppress human CD20+ melanoma stem cells
Нагруженные салиномицином липид-полимерные наночастицы с анти-CD20-аптамерами селективно подавляют стволовые клетки меланомы CD20 + человека (февраль 2018)
Autophagy inhibition enhances antiproliferative effect of salinomycin in pancreatic cancer cells
Ингибирование аутофагии усиливает антипролиферативный эффект салиномицина в клетках рака поджелудочной железы.(ноябрь-декабрь 2017)
Салиномицин подавляет пролиферацию раковых клеток поджелудочной железы зависимым от концентрации образом и уменьшает CD133-положительную фракцию. Салиномицин усиливает аутофагическую активность в этих клетках в зависимости от концентрации. Ингибирование аутофагии сделало клетки рака поджелудочной железы еще более чувствительными к салиномицину .
Salinomycin, as an autophagy modulator-- a new avenue to anticancer: a review
Салиномицин, как модулятор аутофагии - новый путь к
противораковым заболеваниям: обзор. (февраль 2018)
С тех пор, как в 2009 году появилась способность салиномицина (Sal) воздействовать на стволовые клетки рака молочной железы, было проведено множество экспериментов для проверки противоопухолевых эффектов Sal. Они показали, что Sal эффективно индуцирует ингибирование пролиферации, гибель клеток и подавление метастазирования рака человека различного происхождения как in vivo, так и in vitro, не вызывая серьезных побочных эффектов, как обычные химиотерапевтические препараты для организма.
Аутофагия играет разные роли в возникновении, развитии и прогрессировании рака. С одной стороны, аутофагия подавляет злокачественную трансформацию с помощью многих механизмов,
с другой стороны, считается, что после образования опухолевого очага, аутофагия способствует и поддерживает онкогенез и опосредует устойчивость к различным формам противоопухолевой терапии.
Однако Sal-индуцированная аутофагия провоцирует гибель опухолевых клеток, так как ингибирует аутофагию посредством трансфекции миРНК против ATG7 в результате частичного предотвращения индуцированной аутофагией гибели клеток через 24 ч путем ингибирования аутофагии. Sal вызывает аберрантный аутофагический поток через выработку АФК при глиобластоме. Более того, новое исследование показало, что Sal подавляет поздние стадии аутофагии, что приводит к нарушению рециркуляции и накоплению дисфункциональных митохондрий, сопровождающих увеличение производства АФК.
Противоопухолевые свойства салиномицина на цисплатин-резистентных раковых клетках яичников человека in vitro и in vivo: участие активации р38 МАРК
Antitumor properties of salinomycin on cisplatin-resistant human ovarian cancer cells in vitro and in vivo: involvement of p38 MAPK activation
Исследование было направлено на изучение противоракового действия и механизма действия салиномицина, селективного ингибитора раковых стволовых клеток, на резистентные к цисплатину клетки рака яичников человека in vitro и в естественных условиях, для того чтобы найти альтернативные средства для преодоления химиорезистентности при лечении рака яичников. Салиномицин значительно подавлял рост опухоли на модели ксенотрансплантата опухоли. Эти данные свидетельствуют о том, что салиномицин эффективно подавляет рост клеток рака яичника человека, резистентного к цисплатину. Результаты согласуются с предыдущим исследованием клеток рака молочной железы, подтверждая, что резистентные к химиотерапии клетки остаются чувствительными к лечению салиномицином.
На рисунке показана противоопухолевая активность салиномицина у мышей NOD / SCID, несущих клетки C13 человека. (А) Кривые роста опухолей у мышей, получавших салиномицин (5 мг / кг) и контроль с носителем (5% этанол). (B) Окончательный объем опухолей у животных, получавших салиномицин и носитель, на 21-й день после инъекции опухоли. Данные представлены как среднее значение ± стандартное отклонение объемов опухоли (n = 5). Статистически значимая разница по сравнению с контролем транспортного средства (** P <0,01). (C) Одна из мышей контрольной группы с носителем (вверх) и одна из мышей, обработанных салиномицином (вниз). Размер опухоли у мышей, обработанных салиномицином (вниз), был заметно уменьшен по сравнению с опухолью у мышей, обработанных носителем (вверх). Черная полоса, 1 см..
7. https://www.spandidos-publications.com/10.3892/or.2018.6805
Signaling pathway inhibitors target breast cancer stem cells in triple-negative breast cancer
Ингибиторы сигнального пути нацелены на стволовые клетки рака молочной железы при тройном раке молочной железы. октябрь 2018г.
В работе показана эффективность пяти терапевтических агентов, ( DART, висмодегиб, салиномицин, руксолитиниб и статик), которые нацелены на уничтожение стволовых клеток рака молочной железы (BCSC) при тройном негативном раке молочной железы (TNBC). На рисунке видно, что Салиномицин наиболее эффективно воздействовал на опухолевые клетки, в результате чего размер опухоли стал значительно меньше, чем при воздействии другими веществами, в том числе такими противоопухолевыми препаратами, как Висмодегиб и Руксолитиниб.
Лечение этими ингибиторами сигнального пути может обеспечить новую терапевтическую стратегию против TNBC путем нацеливания на BCSC, таким образом обеспечивая многообещающее клиническое применениеу пациентов с TNBC.
8. Salinomycin-Induced Apoptosis in Human Prostate Cancer Cells
Противоопухолевое действие салиномицина при химиотерапевтически устойчивых формах рака.
9.Salinomycin inhibits osteosarcoma by targeting its tumor stem cells
Салиномицин в терапии остеосаркомы
Остеосаркома является наиболее распространенной первичной опухолью костей у детей и подростков и, как правило, прогноз заболевания плохой. Стволовые клетки опухоли (TSC,) являются причиной опухоли инициирования и рецидивов или метастазов. Таким образом, неблагоприятный прогноз остеосаркомы вероятно, является результатом неспособности клеток остеосаркомы созревать. Здесь мы использовали три различных метода для обогащения TSC при остеосаркоме и далее оценивали, может ли салиномицин выборочно воздействовать на TSC остеосаркомы.
Наши результаты показали, что sarcosphere, подбор химиотерапии и стволовых клеток маркера OCT4 или SOX2 сверхэкспрессию все эффективны в обогащении TSC, от линии остеосаркомы клетки.
Дальнейшее исследование показало, что салиномицин ингибирует остеосаркому путем выборочного таргетинга своих стволовых клеток как в пробирке и в естественных условиях без серьезных побочных эффектов, и Wnt / ?-катенин сигнальные пути могут быть вовлечены в ингибирование салиномицином.
По полученным результатам, мы определили, что салиномицин является эффективным ингибитором стволовых клеток остеосаркомы, и поддерживаем использование салиномицина для устранения клеток остеосаркомы и подразумеваем необходимость дальнейшего клинического исследования.